Los estudios sobre el agua
Como es evidente, el hombre no siempre ha sabido todo lo que hoy sabe sobre el agua. Veamos como evolucionaron los estudios que se realizaron sobre el agua a lo largo de la historia de la ciencia:
– Hasta el siglo XVII ni tan siquiera se sospechaba que el agua estaba formada por dos elementos, pensando los científicos que era un cuerpo simple.
– En 1781 el químico inglés Joseph Priestley realizó su síntesis por combustión de Hidrógeno y además crea el primer agua carbonatada
– En ese mismo año Henry Cavendish descubre que es una sustancia compuesta y no un elemento en sí misma y Antoine-Laurent Lavoisier prosigue esos estudios, demostrando que el agua estaba formada por Hidrógeno y Oxígeno
– En 1804, el químico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt consiguen formular el agua, demostrando que son dos átomos de Hidrógeno y uno de Oxígeno los que forman cada una de sus moléculas.
Estructura molecular del agua
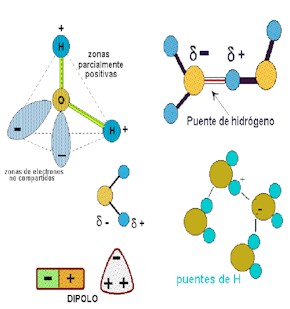
Todos sabemos que la fórmula química del agua es H2O. Esto quiere decir que cada molécula de agua contiene dos átomos de Hidrógeno y un átomo de Oxígeno. A temperatura ambiente el agua está en estado líquido, cosa en principio que llama la atención ya que otras moléculas de parecido peso son gaseosas. El motivo de que el agua sea líquida lo encontramos en la forma en que se encuentra estructurada la molécula del agua. Los dos polos negativos de los dos átomos de Hidrógenos se encuentran desplazados hacia el átomo de oxigeno, por lo que encontramos que en la molécula aparece un polo negativo, justo en el lugar en donde está el Oxígeno y dos polos positivos, donde están los dos Hidrógenos, debido a la menor densidad electrónica. A esta formación se le conoce como dipolos, es decir, aquellas que tienen dos cargas, una positiva y otra negativa, próximas entre sí. Entre estos dipolos se forman los conocidos como puentes de Hidrógeno, que son , en resumidas cuentas, una fuerza de atracción que hace que las moléculas se junten en grupos de entre tres y nueve. Este agrupamiento causa un peso molecular mucho más elevado, por eso el agua se encuentra en estado líquido.
Los puentes de Hidrógeno
Es un enlace que existe gracias a la atracción que hay entre un átomo de Hidrógeno, con carga positiva, y uno de Oxígeno con carga negativa (es decir, un par de electrones libres).
Una molécula de agua se forma por la unión entre un átomo de Oxígeno que tiene seis electrones de valencia (comparte dos y le quedan dos pares de electrones libres) y dos Hidrógenos con un electrón de valencia cada uno. Ambos Hidrógenos ceden este único electrón al Oxígeno, que completa así los ocho polos que precisa.
De este modo, la molécula de agua presenta cuatro cargas parciales y produce una atracción con el par de electrones libres del Oxígeno de otra molécula de agua. Según este planteamiento, una molécula de agua tiene la capacidad de formar cuatro puentes de Hidrógeno.
Estos puentes de hidrógeno son los causantes de la mayoría de las propiedades químicas y muchas de las propiedades físicas del agua.
Algunos datos sobre la estructura molecular del agua
– La molécula del agua tiene forma de tetraedro. El átomo de Oxígeno está en el centro mientras que los átomos de Hidrógeno se encuentran en los vértices de la figura geométrica
– El ángulo que se forma entre los dos átomos de Hidrógeno tiene una medida de 104,5 grados y la distancia entre cada partícula de Hidrógeno y la de Oxígeno es de 0,096 nm
– En el caso del hielo, las moléculas forman una unidad estructural de carácter espacial que se conoce como tetrahidrol.
– Al ser el agua dipolar, sus moléculas rodean a los distintos iones y los aíslan del resto. Esto se conoce como hidratación.
Ver también:
http://docencia.izt.uam.mx/epa/archivos/quimalim/Agua.pdf
http://gmein.uib.es/otros/aguajmol/agua_jmol.html
http://es.wikipedia.org/wiki/Mol%C3%A9cula_de_agua
http://whitesmith.mex.tl/496541_apuntes-2do-bimestre.html (tomada de aquí la imagen)